10월 환자 78명 대상으로 투약 시작
희귀의약품 지정 신청 및 기술수출 추진
[편집자] 이 기사는 8월 3일 오후 3시07분 AI가 분석하는 투자서비스 '뉴스핌 라씨로'에 먼저 출고됐습니다.
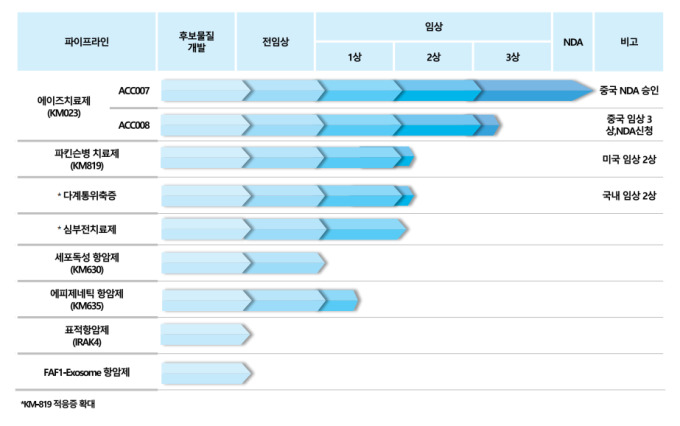
[서울=뉴스핌] 배요한 기자 = 카이노스메드가 파킨슨병 치료제(KM-819) 물질의 적응증으로 개발 중인 희귀 신경 퇴행성 질환 다계통 위축증(MSA) 치료제가 국내 임상 2상에 돌입한다. 다계통위축증은 희귀 질환인 만큼 임상 성공시 조건부 허가를 받을 것이란 기대감도 나온다.
3일 카이노스메드는 관계자는 "오는 10월 다계통 위축증 치료제 임상을 위한 투약을 시작할 계획"이라며 "서울아산병원에서 78명의 환자를 대상으로 매일 한번 400mg 투여하게 된다"고 말했다.
카이노스메드는 KM-819 효능을 인정받아 지난해 11월 식품의약품안전처(이하 식약처)로부터 다계통 위축증 임상시험계획(IND)을 승인을 받았다. 올해 1월 임상 2상에 시작했으며, 2월부터 환자 모집을 시작했다.
다계통 위축증은 뇌신경계 질환으로 신경전달물질인 도파민의 분비가 정상적으로 진행되지 않아 발생하게 된다. 운동장애(파킨슨 증상)와 자율신경계, 소뇌장애 등의 이상으로 발생하는 것으로 알려져 있지만, 뚜렷한 원인을 알지못해 특발성 질환으로 분류돼 있다.
 |
카이노스메드가 개발 중인 다계통 위측증 치료제의 작용기전은 FAF1 억제제로서 도파민 신경세포를 보호. FAF-1의 과발현을 억제함으로써 도파민 신경세포(Dopaminergic neuron)의 사멸을 저해해 다계통위축증의 원인인 알파시누클라인(alpha-synuclein) 단백질 축적을 억제한다.
카이노스메드는 KM-819가 다계통 위축증으로 의한 행동장애를 개선시킬 수 있다는 상관관계를 전임상을 통해 확인했다. 관련 연구에 따르면 KM-819 처리군이 대조군에 비해 60% 이상의 차이로 유의미한 행동 개선을 보였다. 빔 균형 테스트에서 KM-819 처리군은 대조군에 비해 45% 정도의 행동개선을 나타냈다.
회사 관계자는 "다계통 위축증은 발병 후 6~10년 사이에 사망에 이르게 되는 만큼 병의 진행속도가 빠른 퇴행성 신경질환 중 하나로 시장 의학적 수요가 매우 높은 질환"이라며 "환자 수는 파킨슨병의 5-10% 정도의 희귀질환으로 치료 효과가 거의 없어 치료제 개발이 시급하다"고 설명했다. 이어 "현재 몇 개의 임상이 진행 중에 있지만 아직 효능을 보인 약물이 없어 빠른 시장 진입이 가능할 것"이라고 덧붙였다.
회사 측은 2024년 임상 2상이 완료되는 시기에 희귀의약품 지정 신청과 함께 기술수출(라이센스 아웃)도 추진한다는 계획이다.
김두현 하나금융투자 관계자는 "다계통위축증은 파킨슨병과 같은 뇌 퇴행성 질환으로 긍정적인 임상 2상 결과시 파킨슨병 임상 시험에도 긍정적 데이터로 활용될 것"이라며 "다계통위축증은 희귀 질환으로 분류되며 임상 2상 성공시 조건부 허가 기대감도 있다"고 말했다.
다계통 위축증 환자는 매년 증가 추세에 있어 빠른 허가 기대감은 커지고 있다. 건강보험심사평가원 자료에 따르면 지난2020년 다계통 위축증으로 의료기관을 찾은 환자 수는 1951명으로 집계됐다. 이는 2016년 926명 대비 2배 이상 증가한 규모다.
한편 카이노스메드는 뇌질환(파킨슨치료제), 항바이러스(에이즈치료제), 항암제(IRAK4·FAF1-exosome 등) 혁신 신약을 개발 중이다. 파킨슨병 치료제는 미국 자회사(FASCINATE)를 통해 미국 FDA 임상 2상 IND 승인을 받고 임상 2상 1단계를 준비 중이다. 다계 통위축증 치료제는 국내 식약처에서 임상 2상 IND 승인을 받고, 임상을 추진하고 있다. 에이즈 치료제는 중국 파트너사인 장수아이디로 기술 이전한 상태이며, 중국에서 신약승인을 받고 판매를 하고 있다.
yohan@newspim.com























