[뉴스핌=고종민 기자] 인트론바이오가 슈퍼박테리아 치료제인 'N-Rephasin SAL 200'(이하 SAL200)의 기술 수출(라이센싱 아웃)을 연내에 마무리한다.
이어 "최근 들어 항생제 물질 개발사들의 라이센싱 아웃이 활발해지면서 사업 환경이 우호적"이라며 "모 일본 제약사의 경우 자회사가 임상 1상 종료 전에 항생제로써 단독 효능을 갖지 못해도 7억 5000만 달러의 라이센싱 아웃 계약을 성사한 바 있다"고 말했다.
SAL200의 임상 진행 단계는 서울대병원과 국내 임상1상을 완료했으며 임상2상이 식품의약안전처 승인을 기다리는 중이다.
이 관계자는 "항생제는 통계적으로 동물 모델에서 효능 결과가 인체에서도 동일하게 나오는 것으로 알려졌다"며 "개발 프로세스상 중요한 것이 임상 1상"이라고 강조했다.
계약 상대방인 글로벌 제약사가 서울대의 임상 방식을 두고 글로벌 기준에 맞게 보수적으로 하는 만큼 해외 임상도 문제 없이 할 수 있을 것이라는 판단을 했다는 설명이다.
다만 접촉 중인 글로벌 업체명에 대해선 계약상 이유로 함구했다.
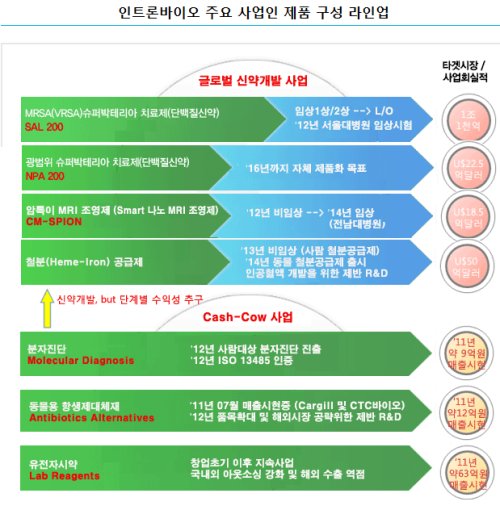
인트론바이오의 신성장동력으로 꼽히는 SAL200은 합성항생제의 내성을 가진 슈퍼박테리아 치료를 위해 개발됐다. 특정 박테리아가 특정 세균만 공격하는 점에서 착안, 박테리오파지(세균의 균체를 녹여서 증식해 세균을 먹는 것) 기술을 항생제에 도입한 것. 즉 특정 세균을 치료하는 표적 치료제 성격을 지닌다.
회사측에 따르면 SAL200은 현재 기존 항생제와 달리 세포벽을 파괴하는 방식으로 내성을 거의 유발하지 않은 결과를 얻어낸 상태다. 이에 더해 SAL200은 세균의 방어막인 바이오필름을 투과하고 10분 내 세균을 사멸하는 효능이 있다.
또 인트론바이오의 SAL200 생산 공정은 기존에 사용되는 스트렙토미세스(streptomyces, 토양 속에 널리 분포하는 방선균) 배양 공정에 비해 시간을 단축한 대장균 배양 방식으로 제조한다. 배양 시간이 단축되는 만큼 경제성이 높다는 게 회사 측의 설명이다.
한편 SAL200은 최근 나타난 변종 슈퍼박테리아인 MRSA(Methicillin Resistant Staphylococcus Aureus, 항생제 메치실린에 내성을 가진 황색포도상구균)과 VRSA(Vancomycin Resistant Staphylococcus Aureus, 항생제 반코마이신에 내성을 가진 황색포도상구균)의 감염증 치료를 위해 개발됐다. 질병관리본부의 '병원 내 슈퍼박테리아 감염 신고 현황"에 따르면 우리나라는 2011년 2만2928건에서 2012년 4만4174건, 2013년 8만955건으로 감염건수가 급증하고 있으며, 신생아들의 슈퍼박테리아 보균률이 40%가량 된다는 통계도 있다.
[뉴스핌 Newspim] 고종민 기자 (kjm@newspim.com)