알테오젠, 허셉틴 바이오시밀러 연내 임상3상 돌입
美 시장 열리는 2019년 전 개발 완료 목표
셀트리온ㆍ삼성바이오에피스 추격..7조 시장 공략
[편집자] 이 기사는 4월 18일 오전 11시1분 프리미엄 뉴스서비스'ANDA'에 먼저 출고됐습니다. 몽골어로 의형제를 뜻하는 'ANDA'는 국내 기업의 글로벌 성장과 도약, 독자 여러분의 성공적인 자산관리 동반자가 되겠다는 뉴스핌의 약속입니다.
[뉴스핌=한태희 기자] 국내 제약사들이 7조원 규모의 유방암 치료 바이오시밀러(바이오의약품 복제약) 시장 공략에 속도를 내고 있다. 대형사인 삼성바이오에피스와 셀트리온이 앞서가고, 동아쏘시오와 손잡은 알테오젠이 따라가는 형세다.
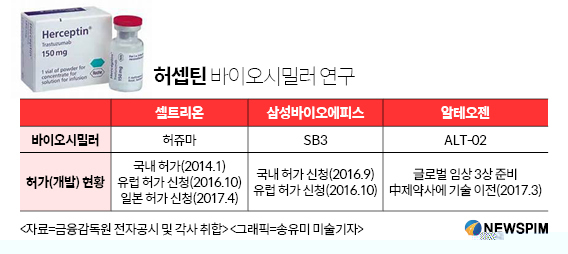
18일 바이오 업계에 따르면 코스닥 상장사인 알테오젠은 연내 허셉틴 바이오시밀러 'ALT-02'에 대한 글로벌 임상 3상에 들어갈 예정이다. 허셉틴은 글로벌 제약사인 로슈의 자회사 제넨텍이 개발한 유방암ㆍ위암 치료제로, 전세계에서 연간 7조원 넘게 처방되고 있다. 유럽에 이어 미국에서도 특허가 만료될 예정이어서 국내외 바이오시밀러 업체들이 눈독을 들이고 있다.
알테오젠이 개발한 ALT-02는 지난해 캐나다에서 임상1상을 마치고, 상용화 전 단계인 임상3상을 앞두고 있다.
2008년 설립된 알테오젠은 지난해 연결 기준으로 68억원의 매출을 올린 소규모 제약사지만, 자체 개발한 단백질(NexP)을 기존 의약품에 접목하는 연구를 할 정도로 기술력을 갖췄다는 평가다. 다만 바이오시밀러를 대량으로 만들 수 있는 생산 설비는 아직 없다.
알테오젠은 ALT-02 상용화를 위해 최근 동아쏘시오홀딩스 및 디엠바이오와 손을 잡았다. 디엠바이오는 바이오 사업에 진출하려는 동아쏘시오홀딩스가 세운 회사다. 이번 업무 협약에 따라 디엠바이오는 글로벌 임상3상에 쓸 ALT-02를 생산, 알테오젠에 공급하게 된다. 양사는 생산 물량과 시기 등을 조율 중이다. 디엠바이오는 8000리터 규모 바이오의약품 생산 설비를 갖추고 있다.
임상 1상이 소수의 환자들을 대상으로 신약 안전성을 확인하는 단계라면 임상3상은 신약 효과·효능, 부작용, 안정성, 적정 용량 등을 검증하는 단계다. 최소 수백명을 대상으로 임상을 하기 때문에 바이오시밀러를 안정적으로 공급받는 게 중요하다. 알테오젠이 동아쏘시오홀딩스 및 디엠바이오를 파트너로 삼은 이유다.
알테오젠 관계자는 "디엠바이오와 임상 시료 생산량과 시기 등을 논의하고 있다"며 "아무리 늦어도 올해 안에 임상 3상을 시작해야 한다"고 강조했다.
 |
알테오젠은 임상3상을 2019년 전에 마친다는 계획이다. 허셉틴 유럽 특허는 2014년 끝났으며, 미국 특허는 2019년 6월 만료된다. 2019년 하반기부터 미국에서 허셉틴 바이오시밀러를 판매할 수 있다는 얘기다. 한국보건산업진흥원에 따르면 2014년 기준으로 해외 항암제 시장에서 미국 비중은 무려 42.2%다.
한 바이오사 관계자는 "몇 개 회사가 (허셉틴 바이오시밀러를) 독과점한 상황이면 어렵지만 지금 미국 시장은 열리지도 않았다"며 "특허 만료 전에 바이오시밀러 허가를 받고 우수성만 입증할 수 있다면 경쟁할 수 있다"고 설명했다.
국내 바이오 선두주자인 셀트리온과 삼성바이오에피스도 허셉틴 바이오시밀러에 공을 들이고 있다. 셀트리온은 2014년 '허쥬마'란 이름으로 식품의약품안전처의 허가를 받았다. 국내 발매는 안했지만, 마음만 먹으면 언제든지 판매에 나설 수 있다는 얘기다. 지난해에는 미국 다음으로 큰 시장인 유럽의약국(EMA)에 허가를 신청했다.
삼성바이오에피스는 'SB3' 이름으로 지난해 9월 식약처 품목 허가를 신청했다. 같은 해 10월에는 EMA에 판매 허가 신청서를 냈다. 양 사는 미국 식품의약국(FDA)에도 판매허가 신청을 준비중이다.
한편, 허셉틴 물질특허는 미국에서 2019년 6월 만료되고 용법 등의 특허는 2030년까지다. 셀트리온은 미국 시장 진출을 앞당기기 위해 제넨텍을 상대로 총 5건의 특허 무효 소송을 청구했으며, 소송이 진행중이다.
[뉴스핌 Newspim] 한태희 기자 (ace@newspim.com)