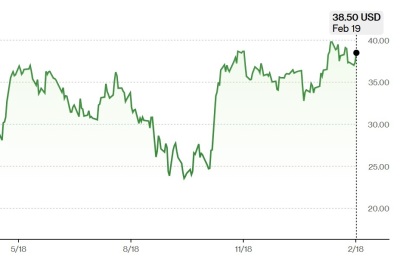
[뉴스핌=박예슬 기자] 한미약품은 4일, 식품의약품안전처 중앙약사심의위원회(이하 중앙약심)의 ‘올무티닙(올리타정)’ 제한적 허가유지 조치에 대해 "성실하게 안전관리조치를 이행해 나가겠다”고 밝혔다.

이날 오전 식약처는 중앙약심을 열고 최근 임상 과정에서 부작용이 일어난 한미약품의 올무티닙염산염일수화물(제품명 올리타)에 대해 중앙약심을 열고 허가를 유지할 것인지 여부를 논의했다.
그 결과 기존 치료제로는 효과가 없어 더 이상 치료방법이 없는 말기 폐암환자를 대상으로 의사의 전문적 판단 하에 부작용 등을 고지한 뒤 동의를 받고 사용할 수 있는 ‘제한적 허가 유지’ 결정을 내렸다. 기존 올리타의 시판허가 자체는 계속 유지된다.
앞서 한미약품은 지난 2일 긴급 기자회견을 열고 올무티닙의 약물 개발을 계속 진행하겠다는 뜻을 밝혔다.
이날 손지웅 한미약품 부사장은 “한미약품은 스폰서 변경 등을 통해 남은 임상을 한미약품 책임 하에 계속 진행할 것”이라며 “향후 개발 방안에 대해서는 분석 중이며 파트너와 긴밀히 협의해 개발 방향을 확정하겠다”고 언급했다.
한미약품에 따르면 현재 올무티닙 임상에 참여하고 있는 환자는 총 127명이다. 이 결과에 따라 향후 좀더 큰 규모의 임상3상도 진행할 예정이다.
앞서 지난달 29일 베링거인겔하임이 올무티닙의 개발 중단을 선언한 이후 잔여 임상 및 개발은 한미약품의 책임 하에 진행되고 있다.
한편, 올무티닙은 한미약품이 개발한 신약으로 국산 27번째 신약에 등록됐다. 식약처는 올무티닙에 대해 지난 5월 신속허가제로 임상2상 후 조건부 시판허가를 냈다. 지난해 한미약품은 베링거인겔하임과 약 8000억원대 올무티닙 기술수출 계약을 맺었으나 베링거 측이 개발 권리를 포기했다.
[뉴스핌 Newspim] 박예슬 기자 (ruthy@newspim.com)