[편집자] 이 기사는 12월 2일 오전 11시 43분 프리미엄 뉴스서비스‘ANDA'에 먼저 출고됐습니다. 몽골어로 의형제를 뜻하는 'ANDA'는 국내 기업의 글로벌 성장과 도약, 독자 여러분의 성공적인 자산관리 동반자가 되겠다는 뉴스핌의 약속입니다.
[뉴스핌=김양섭 기자] 신약개발업체 지트리비앤티가 미국 자회사 리젠트리를 통해 미국 3상을 진행중인 안구건조증 치료제 신약(GBT-201/RGN-259)에 대한 기술수출(라이선스아웃)을 추진 중이다. 회사 측은 일부 다국적제약사와 미팅을 갖는 등 태핑(사전 시장조사)작업에 착수한 상태로 본격적인 협상은 내년 5월 임상 리포트가 나오는 시점으로 기대하고 있다.
 2일 바이오업계에 따르면 지트리비앤티는 최근 미국에서 열린 안과 관련 학회에서 기술수출 논의를 위해 다국적제약사 2곳와 미팅을 가졌다. 최준원 지트리비앤티 상무는 "미국에서 안과 관련 학회에서 두 군데 정도 다국적제약사와 미팅을 가졌다"고 확인했다.
2일 바이오업계에 따르면 지트리비앤티는 최근 미국에서 열린 안과 관련 학회에서 기술수출 논의를 위해 다국적제약사 2곳와 미팅을 가졌다. 최준원 지트리비앤티 상무는 "미국에서 안과 관련 학회에서 두 군데 정도 다국적제약사와 미팅을 가졌다"고 확인했다.
다만 "아직까지 초기단계"라면서 "내년 5월에 데이터가 나오면 본격적으로 딜을 해야 하고 그전에 태핑하는 단계"라고 설명했다. 기술수출 기대 규모와 관련해선 "아직 내부적으로 결정된 바 없다"고 답했다.
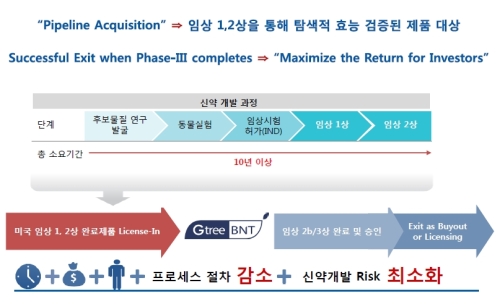
지트리비앤티는 지난 9월 3상 임상시험에서 첫 피험자군을 대상으로 시험약 투여를 시작했다. 내년 5월까지 임상리포트를 내는 게 목표다. 양원석 지트리비앤티 대표이사는 "이 구간(임상리포트 발표 시기)을 최적의 딜 타이밍으로 보고 있다"고 말했다.신약개발 과정읔 크게 후보물질을 개발 또는 발굴한 뒤 동물실험을 거쳐 사람을 대상으로 하는 임상 단계에 돌입한다.
임상단계는 일반적으로 1~3상 단계로 이뤄지며 1상은 안정성, 2상은 유효성, 3상은 대규모 피험자를 대상으로 종합적 검증을 하는 절차다. 이후 품목허가 등을 받은 뒤 상용화 단계에 들어서게 된다. 국내에서도 지난 7월 3상 승인을 받아놓은 상태다. 다만 현재 지트리비앤티는 가장 큰 시장인 미국에 주력하고 있다.
안구건조증에 대한 미국 처방의약품은 현재 앨러간의 'Restasis'가 유일하다. 지난 10여년간 미국 시장을 독점 중이다. 시장 규모는 단일품목으로 연간 1조원이 넘는 것으로 추정되고 있다.
안구건조증 치료제와 관련 3상까지 온 업체는 리젠트리 외에 미국 제약사 샤이어(shire), 바이오벤처 미메토젠(mimetogen) 정도다. 두 회사 모두 3상 진행중에 기술수출을 한 것으로 알려졌다. 다만 정확한 딜 규모는 알려지지 않았다. 지트리비앤티측은 딜 추정 규모를 각각 7억달러, 5억~10억달러 정도로 추산하고 있다.
지트리비앤티는 현재 51%인 리젠트리의 지분을 지속적으로 늘리겠다는 계획이다. 양 대표는 "현재 51%에서 3상 완료시 58% 등 지속적으로 늘려 75%까지 지분을 확보할 계획"이라고 말했다.
지트리비앤티는 옛 디지털아리아로 전 차바이오앤디오스텍 경영진 출신 인력이 인수 후 신약개발 사업을 추가시킨 기업이다. 지트리비앤티의 자회사 지트리파마슈티컬은 기술 도입 후 개발 및 상업화를 주목적으로 하는 디벨로퍼를 지향하고 있다. 대부분의 임상자원을 아웃 소싱으로 조달하며, 회사는 데이타(data)관리 및 프로젝트 통솔에 주력한다. 양 대표는 "우리는 R&D에서 R은 하지 않는 회사다"라면서 "잠재가능성이 있는 것을 잘 찾아내서 개발한 뒤 라이선스 아웃을 하는 회사"라고 설명했다.
한편 지트리비앤티는 올해 3분기까지 매출 120억원, 영업손실 23억원, 당기순손실 31억원을 냈다.
[뉴스핌 Newspim] 김양섭 기자 (ssup825@newspim.com)























