이연제약 "특허·자료 등 계약서대로 이행하라"
바이로메드 "美 상용화 과정, 자료도 다 줬다"
임상3상 시료 공급도 "의무없다" vs "전부터 요구"
[뉴스핌=박미리 기자] 14년 동지 이연제약과 바이로메드 간 갈등이 한층 격화하는 모습이다. 오랜기간 유전자치료제 개발이라는 목표를 향해 두 손을 맞잡아온 양사는 소송전에 돌입한 뒤 팽팽한 신경전을 펼치고 있다.
유용환 이연제약 대표는 지난 29일 서울 코엑스에서 열린 임시 주주총회 이후 바이로메드과의 소송과 관련, "이연제약이 다 된 밥에 숟가락 얹는 것 아니냐고 생각할 수 있다"며 "우리는 그저 바이로메드에 계약서(2004년) 문구 그대로 이행할 것을 촉구하고 있을 뿐"이라고 목소리를 높였다.
이어 그는 "흔들려고 했다면 주식을 늘려 경영참여를 했을 것"이라며 "우리도 이 프로젝트(VM202)의 원활한 진행을 원한다"고 강조했다.
 |
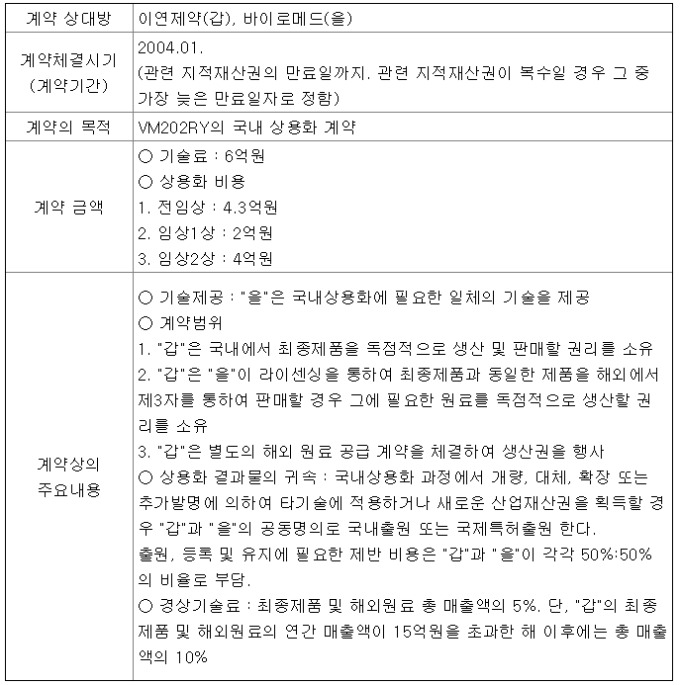
이연제약은 지난달 17일 13년간 협력관계를 맺어온 바이로메드에 유전자치료제 VM202 관련 ▲출원·등록한 특허 지분 변경(명의 변경 및 이전 통한 지분 50% 요구) ▲전임상 연구 및 임상 데이터 자료 제공 ▲해외공장에서 이뤄진 DNA 원료 및 완제 생산 자료 제공을 요구하는 소송을 제기했다.
VM202는 당뇨병성 신경병증(DPN)·당뇨병성 허혈성 궤양(PAD)·근위축성 측삭경화증(루게릭·ALS)·허혈성 심장질환(CAD) 등 4가지 적응증을 목표로 개발되고 있는 유전자 치료제다. 현재 미국에서 임상 3상(DPN·PAD)과 임상 2상(ALS)이 진행되고 있다. 한국에서는 임상 2상(CAD)이 진행 중이다.
양사는 2004년 맺은 계약의 해석을 놓고 갈등을 빚고 있다. 이연제약은 기술료 및 국내 상용화 비용을 대는 조건으로, VM202 완제품 국내 독점 생산·판매권, 해외 판매 시 원료 독점 생산권, 국내 상용화 과정에서 산업재산권 추가 획득 시 공동명의의 국내 및 국제 특허 출원권 등을 받기로 한 것으로 알려졌다.
◆ 특허 지분 50% 권리?
이 중 공동명의의 특허 출원권이 이연제약이 요구한 '특허 지분 50% 이전'에 대한 근거다. 유 대표는 "2004년 계약한 최초 물질 CAD에서 적응증이 파생됐다. 그 결과물이 DPN, PAD"라며 "계약을 하면서 우리가 백기사 역할을 했다. 또 비임상부터 임상2상이 없었다면 3상도 없었을 것"이라고 주장했다.
이어 그는 "저희는 바이로메드에 비용을 모두 지불했다"며 "임상바이로메드 재무제표를 살펴보면 임상약에서 매출이 났다. 임상약에서 매출이 난다는 것이 이해가 되지 않지 않느냐"고 했다. 바이로메드가 연구기업이기 때문에 임상약이 수익으로 잡힐 수 없다는 논리다.
반면 바이로메드 관계자는 "저희는 (최초물질의 파생이라는) 이연제약 주장이 올바르지 않다고 생각한다"며 "국내 임상은 미국에서의 임상 결과물을 바탕으로 진행된 것이다. 애초 2004년 맺은 계약에는 이연제약에 국내 상용화에 필요한 특허를 사용할 수 있는 권리를 줬다"고 맞섰다.
그는 임상약 매출에 대해서도 "이연제약은 국내 상용화에 해당하는 비용만 지원했다"며 "미국 임상시험에 해당하는 비용은 이연제약이 판권을 지닌 영역이 아니기 때문에 지원하지 않았다"고 말했다.
◆ 연구·생산자료 다 못받았다?
양사는 VM202 연구·생산자료에 대해서도 "전달했다(바이로메드)", "받지 못했다(이연제약)"로 정반대 주장을 펼치고 있다.
유 대표는 "VM202 허가 이후 충주공장에서 생산하려면 임상에 사용된 약과 동등하다는 입증을 받아야한다. 기술자료가 없는데 어떻게 동등성을 입증할 수 있겠느냐"며 "임상 과정에서 누적된 이력(자료)이 넘어오지 않으면 다른 약이 돼버려 국내에서 승인을 받을 수 없다"고 밝혔다.
이연제약은 지난 8월 VM202를 비롯한 유전자치료제 생산공장 충주공장 착공에 들어갔다. 향후 충주공장에서 VM202 완제, 원료 의약품을 생산하려면 연구·생산자료가 필수적이라 생산권을 지닌 회사로서 이러한 요구는 당연하지만 충분한 자료를 받지 못했다는 것이 이연제약 주장이다.
반면 바이로메드 관계자는 "자료가 없었다면 한국에서 임상2상 허가를 어떻게 받았겠느냐"며 "이연제약이 한국에서 임상시험을 진행하면서 허가를 받기 위해 필요한 모든 자료를 제공했다"고 밝혔다.
◆ 2018년 시료 공급해야?
현재 양사는 2018년 바이로메드 미국 임상3상에 시료(DNA)를 공급하는 문제에 대해서도 마찰을 빚고 있다.
유 대표는 이에 대해 "우리는 임상3상에 시료(DNA)를 대지 않아도 된다. 2018년에 해야할 의무가 없다"며 "저희 충주공장 일정도 바이로메드 일정에 전혀 지장이 없다"고 주장했다.
하지만 바이로메드 관계자는 "제품을 상용화하는 입장에서 상용화가 가능한 생산시설에서 생산된 시료가 임상3상에 활용되는 것이 좋다"며 "물론 더 일찍 제공해주는 것이 좋지만 그게 시간적으로 불가능했기에, 원료생산자인 이연제약에 임상3상에 공급할 수 있도록 준비해달라 요청했다"고 말했다.
이어 "상용화 후 충주공장에서 생산된 제품과 동등성 입증을 하면 된다는 주장을 할 수 있지만, 저희 입장으로서는 굉장히 번거로워지는 일"이라고 덧붙였다.
[뉴스핌 Newspim] 박미리 기자 (milpark@newspim.com)























