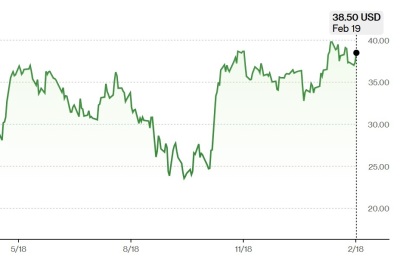
[서울=뉴스핌] 이나영 기자= 디와이디가 미국 임상기관과 협력해 타액기반 진단키트의 FDA 승인 추진을 본격화한다고 16일 밝혔다. 이를 위해 시간과 비용을 최적화할 수 있는 클리아랩을 통해 임상 시험을 진행한다.
디와이디는 미국 메릴랜드 몽고메리 카운티에 소재한 임상수탁 기관(클리아랩. CLIA Lab)인 PMCDx와 MOU를 체결했다. 클리아랩은 FDA 인증 임상시험 수행 기관이며 PIMCDx는 미국 48개 주를 커버한다.
디와이디 회사 관계자는 "클리아랩을 이용하면 자체 개발한 실험실개발테스트(LDT)를 별도의 FDA 승인 없이 사용할 수 있어 FDA 승인에 필요한 비용과 시간을 절약할 수 있다"고 밝혔다.

PMCDx와의 업무 협약은 지난달 4일 소프트랜딩 업무 협약을 체결한 몽고메리 카운티의 추천으로 이루어진 것이다. PMCDx는 디와이디의 진단키트에 대해 특별한 관심을 보이며 임상 실험 데이터 제공과 함께 제품 사용을 희망하는 의향서(LOI)까지 제출했다.
디와이디는 신속한 FDA 승인을 위해 미국 FDA 전문 컨설팅 업체 Globizz와도 긴밀한 협의를 진행하고 있다고 전했다. 아울러 메릴랜드 대학의 임상 실험 지원 프로그램인 MIPS를 통해 임상 시험 지원을 추진할 예정이며 이 또한 몽고메리 카운티의 적극적인 추천에 따른 것이라고 회사측 관계자는 설명했다.
디와이디는 임상 기간 동안 메릴랜드 대학팀과 함께 미국 의료정보화서비스(MD IHC)를 활용한 데이터 수집과 AI 연구를 수행하고, 당뇨병 치료를 위한 최신 기술도 공동 개발한다는 계획이다.
디와이디는 오는 5월 PMCDx와 본계약을 체결하고 6월부터 임상실험 대상자 모집을 시작해 2025년 연내 임상을 완료할 계획이다.
nylee54@newspim.com