[세종=뉴스핌] 신도경 인턴기자 = 식품의약품안전처가 최신 국제 기준에 따라 의약품 동등성 시험 기준을 정비한다.
식약처는 신약, 국내 최초로 허가받은 의약품과 동등성이 인정된 제네릭 의약품의 신뢰성을 위해 '의약품 동등성 시험 기준'(식약처 고시)을 개정·시행한다고 9일 밝혔다.
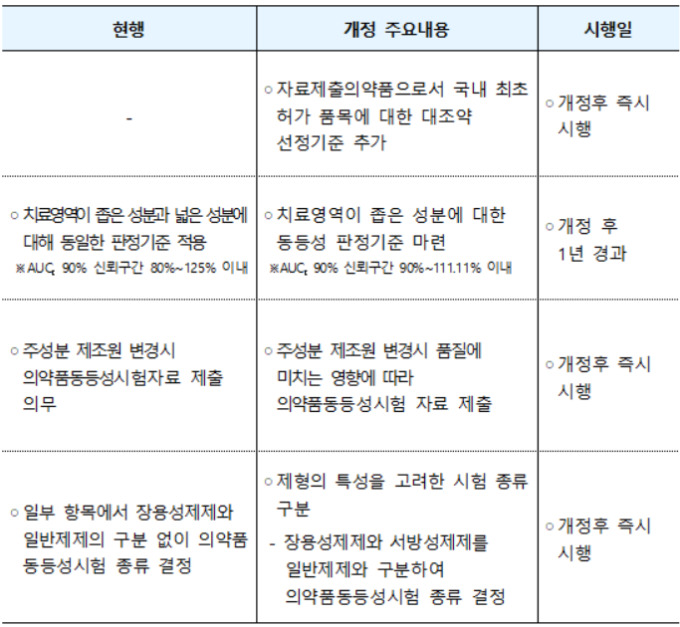
이번 개정의 주요 내용은 ▲대조약 선정기준 추가 ▲치료영역이 좁은 성분 3종을 추가 ▲의약품동등성시험 제출자료 완화 ▲장용성제제 등 첨가제 변경시 제출자료 정비 등이다.
현행 식약처 고시엔 제네릭 의약품 생산 과정에서 비교대상이 되는 의약품인 대조약 선정기준이 없다. 이번 개정을 통해 자료제출의약품으로서 국내 최초 허가 품목에 대한 대조약 선정기준을 마련한다.
아울러 그동안 장용성제제와 일반제제 구분이 없던 의약품 동등성 시험 종류를 장용성제제, 서방성제제, 일반제제로 세분화해 의약품동등성 시험을 시행한다.
개정 후 1년이 경과한 후엔 용량이 작아도 치료 실패와 부작용이 나타날 수 있는 성분을 34종에서 37종으로 확대 시행하고 동등성 판정 기준을 새로 마련한다.
주성분 제조원 변경 시 의약품 동등성시험자료 제출을 의무화 했던 현행 법안에서 품질에 미치는 영향에 따라 자료를 제출하도록 해 안전성을 강화할 예정이다.
안영진 식약처 의약품정책과장은 "안전하고 효과적인 의약품 공급을 위해 앞으로도 의약품 허가심사 체계를 정비하겠다"고 밝혔다.
sdk1991@newspim.com