[서울=뉴스핌] 박다영 기자 = 엘러간의 인공유방 제품이 희귀암을 우발한다는 우려가 제기되자 보건당국이 제품 회수에 착수하면서 인공유방과 관련 안전성 정보를 제공하고 나섰다.
식품의약품안전처는 인공유방 이식의 부작용으로 제기되는 '역형성 대세포 림프종'(BIA-ALCL)을 예방하기 위해 안전성 정보를 제공한다고 7일 밝혔다.
 |
BIA-ALCL은 면역체계와 관련된 희귀 암의 한 종류다. 유방암과는 별개의 질환으로, 장액종으로 인한 유방 크기 변화, 피막에 발생한 덩어리나 피부 발진 등의 증상이 나타난다.
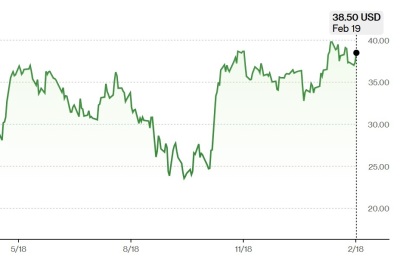
식약처는 엘러간의 인공유방이 2007년 허가 이후 약 11만개가 수입됐으며 최근 3년간 약 2만9000개가 유통된 것으로 파악하고 있다.
최근 미국 식품의약품청(FDA)의 안전성 서한을 받고 엘러간은 부작용 예방 차원에서 자진 회수조치에 나섰다. 회수 조치는 국내를 포함해 전 세계에서 진행되는 것으로 알려졌다.
이에 식약처는 병원과 의사들에게 해당 보형물 이식을 중단하고 남아있는 물량은 업체에 반품해달라고 당부한 바 있다. 더불어 환자와 의사에 인공유방의 안전성과 관련한 정보를 제공한다.
인공유방을 이식한 환자에는 △증상이 없을 경우 예방 차원의 제거를 권고하지 않으며 △가슴이 커지거나 덩어리가 생기는 BIA-ALCL 의심 증상이 있으면 신속히 의료기관을 방문해 검사를 받아야 한다는 사실을 알린다.
또한, 의료인에 △인공유방 이식 환자가 BIA-ALCL 의심 증상을 보이면 신속히 의료기관을 방문해 검사할 것을 설명하고 △BIA-ALCL이 의심되면 장액과 피막 표본을 채취해 병리학 검사를 실시해야 한다고 알릴 예정이다.
식약처는 BIA-ALCL을 비롯한 인공유방 부작용 예방을 위해 △안전성 정보 제공 및 카드뉴스, 가이드라인 배포 △인공유방 재평가로 사용시 주의사항 강화 △인공유방 수술 동의서 마련 등 조치를 취해왔다.
식약처는 "인공유방 환자에 부작용이 발생하면 환자의 건강 상태를 지속적으로 점검할 수 있도록 인공유방의 부작용 조사를 위한 환자 등록 연구를 8월부터 실시할 예정"이라고 말했다.
allzero@newspim.com