찾아가는 허가·심사 체계로 밀착 지원
신개발 의료기기 수수료 9843만원 조정
[세종=뉴스핌] 신도경 기자 = 신개발 의료기기 허가·심사 기간이 기존 80일에서 60일로 단축된다.
식품의약품안전처는 첨단기술이 적용된 신개발 의료기기의 개발을 촉진하고 맞춤형 허가·심사 지원 방안을 마련하기 위한 '의료기기법 시행규칙' 개정안을 1일 개정·공포했다고 밝혔다.
신개발 의료기기는 이미 허가받은 제품과 비교해 작용 원리, 원재료 중 하나 이상이 국내 최초로 적용되는 제품이다. 국민의 치료 기회를 확대하고 국내 의료기기산업의 시장 선점에 중요한 역할을 한다.
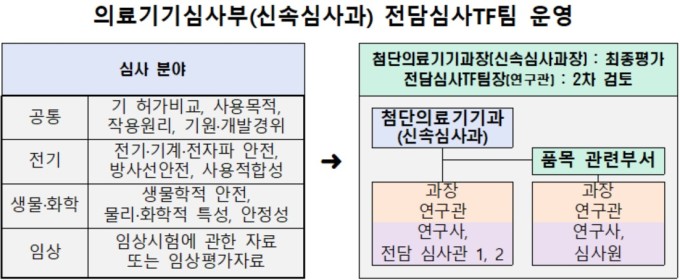
개정안 공포에 따라 신개발 의료기기 허가·심사 기간은 기존 80일에서 60일로 단축된다. 식약처는 의료기기 제조·품질관리기준(GMP)에 대한 적합성 심사를 신청하는 경우 우선 실사를 진행해 평균 심사 소요 기간의 3분의 2 내로 처리할 계획이다.
신개발 의료기기 허가를 신청하는 경우 접수일로부터 7일 이내에 심사 분야별 신개발 의료기기 전담팀이 구성된다. 전담팀과 신청인과의 회의 등을 통해 신개발 의료기기의 허가·심사를 밀착 지원하는 등 '찾아가는 허가·심사 체계'를 구축할 예정이다.
신개발 의료기기 수수료도 조정된다. 그동안 신개발 의료기기 수수료는 의료기기 허가·심사와 동일한 수수료인 149만원으로 적용됐다. 이를 수익자 부담 원칙을 적용해 9843만원으로 조정한다. 고역량 심사원도 추가로 채용해 허가와 심사 전문성을 강화한다.
다만 중소기업이 신개발의료기기 허가를 신청하는 경우 허가 수수료를 50% 이내로 감면한다. 의료기기 제조업체가 대부분 영세하고 중소 규모로 운영되고 있는 상황을 감안해 업계 부담을 줄이고 제품 개발 의지를 고취하기 위해서다. 자세한 내용은 식약처 대표 누리집에서 확인할 수 있다.
식약처는 "이번 개정으로 허가·심사에 대한 내실을 강화하고 신개발의료기기의 개발과 신속 제품화를 지원해 국내 의료기기의 시장 경쟁력을 높이겠다"며 "국민의 안전을 최우선의 가치로 두고 제도를 합리적으로 개선할 계획"이라고 설명했다.
sdk1991@newspim.com























