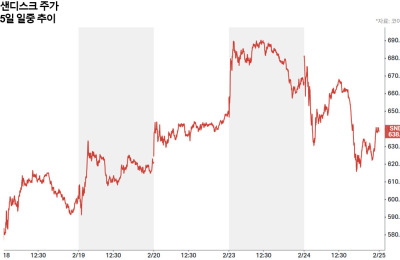
[서울=뉴스핌] 방보경 기자 = 셀트리온은 지난 5일 유럽의약품청(EMA)에 휴미라(Humira, 성분명: 아달리무맙) 바이오시밀러 유플라이마(개발명: CT-P17)의 20mg/0.2ml 용량 제형을 추가하는 품목 변경 허가 신청을 했다고 밝혔다.
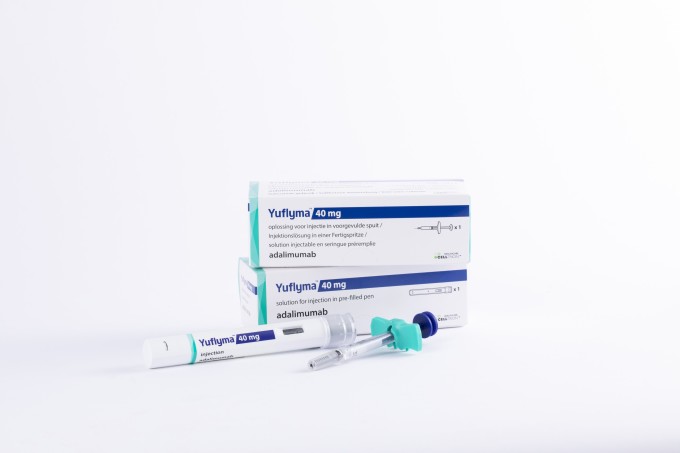
셀트리온은 기존 허가 받은 유플라이마 40mg/0.4ml과 80mg/0.8ml 두 가지 용량 제형에 더해 이번 용량 제형을 추가 신청한다. 오리지널 제품 및 경쟁 바이오시밀러 대비 동등한 파이프라인을 확보하고 유플라이마 제품 경쟁력 강화에 나선다는 방침이다.
이번 제형이 추가되면 소아 환자 범위가 확대돼 몸무게가 적게 나가 저용량 투여가 요구되는 소아 환자들에게도 유플라이마를 공급할 수 있게 된다. 일부 국가의 입찰 참여 조건을 충족하거나 평가 점수 상향에도 영향을 미칠 것으로 예상된다.
셀트리온 관계자는 "남은 허가 절차도 차질없이 진행하고 글로벌 시장에서 제품 경쟁력 강화를 위해 최선을 다하겠다"고 말했다.
hello@newspim.com