[뉴욕=뉴스핌]김근철 특파원=엔지켐생명과학이 구강점막염 치료 신약으로 개발중인 'EC-18'의 미국 임상 결과 단기 추적조사에서 위약군 대비 중증 구강점막염의 지속 기간이 100% 감소한 것으로 나타났다고 발표했다.
엔지켐생명과학은 19일(현지시간) 미국 뉴저지 티넥 매리어트 호텔에서 임상 2상 결과 언론 발표회를 갖고 이같이 밝혔다.
엔지켐생명과학은 미국의 21개 의료기관에서 항암화학방사선요법 치료를 받는 구강점막염 환자 105명을 대상으로 EC-18의 임상 2상을 진행했으며 중증 구강점막염 지속기간을 1차 평가지표로, 중증 구강점막염 발생률을 2차 평가지표호 활용했다고 밝혔다.
임상 2상 결과 EC-18은 치료기간 및 단기적 추적조사 기간 동안 중증구강점막염 발생 기간을 위약군 대비 13.5일에서 0일(100%)로 줄였다. 또 치료기간 동안 중증구강점막염 발생률은 위약군 대비 37.1% 감소된 것으로 나타났다.
이밖에 EC-18은 치료기간 맟 단기적 추적조사 기간동안 중증구강점막염 발생률을 위약군 대비 35.1% 감소시켰다고 회사는 밝혔다.
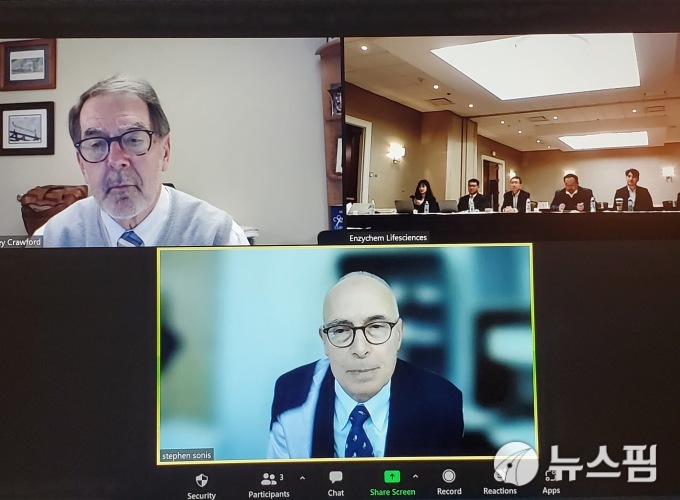 |
| 엔지켐생명과학 구강점막염 신약 미국 임상 2상 결과 발표회에 제프리 크로▶포드 듀크대 의대 교수(왼쪽), 스티븐 소니스 하버드대 의대 교수(아래)와 미국법인 관계자들이 참석해 있다. [사진=엔지켐생명과학 제공] |
이날 화상으로 임상 발표에 참가한 스티븐 소니스 하버드대 교수는 "이번 임상 2상 결과는 매우 고무적인 것"이라면서 "아직 FDA가 승인한 약물 및 치료법이 없기 때문에 EC-18과 같은 경구투약 약물은 환자들에게 큰 도움을 줄 수 있을 것"이라고 평가했다.
조도현 엔지켐생명과학 최고운영책임자(COO) 겸 미국법인 대표는 "현재 경쟁하는 약물 중에서 최고의 결과가 도출됐기 때문에 이를 바탕으로 미국 식품의약국(FDA)에 혁신적 치료제(BTD) 지정을 신청할 예정"이라고 밝혔다. FDA의 혁신적 치료제는 치료제가 없는 질병을 치료하기 위한 약물의 개발 및 검토를 촉진하기 위한 제도다.
엔지켐생명과학은 오는 28일쯤 FDA에 혁신적 치료제 신청을 할 예정이며, FDA는 60일 이내에 검토를 마치고 결정을 내리게 된다고 밝혔다. 회사는 경쟁 약물을 개발하는 미국 갈레라테라퓨틱스가 임상 2상에서 중증 구강점막염 발생기간을 92%가량 줄인 결과로 BTD 지정을 받았기 때문에 이보다 양호한 결과가 나온 EC-18에 대해서도 순조롭게 승인이 나올 것으로 기대한다고 밝혔다.
엔지켐생명과학은 임상 2상 결과를 바탕으로 기존에 협의를 해온 글로벌 대형 제약사와 전략적 파트너를 구성해 라이센싱 계약을 통해 내년 상반기 중에 미국에서 임상 3상을 진행할 예정이라고 밝혔다.
김태훈 기술이전 총괄이사는 "이미 미국과 일본 등에서 각각 전략적 파트너사가 될 기업들과 기술이전 논의를 해왔다"면서 "넓은 유통채널을 확보하고, 신약 상품화에 경험이 풍부한 글로벌 제약사와 일본 지역을 제외한 글로벌 라이센싱 계약을 맺을 계획"이라고 밝혔다.
한편 손기영 엔지켐생명과학 회장은 "치료제가 없는 시장에 경쟁사들보다 월등한 결과를 확보한 만큼 다국적 제약사 들과의 기술이전을 통해 글로벌 블록버스터 개발에 성공하겠다"는 입장을 밝혔다.
kckim100@newspim.com