[서울=뉴스핌] 박다영 수습기자 = 대웅제약은 유럽의약품청(EMA) 산하 약물사용자문위원회(CHMP)로부터 ‘나보타(유럽제품명: 누시바)’의 미간주름 적응증에 대해 26일(현지 시각) '허가승인 권고' 의견을 받았다고 발표했다.
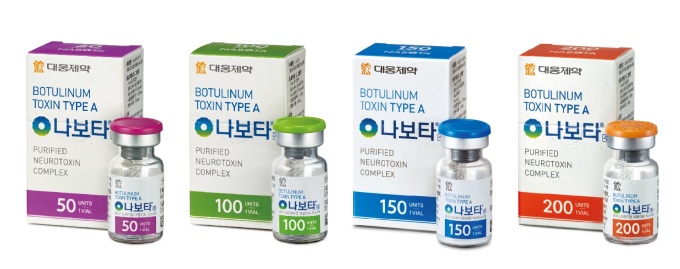
나보타는 대웅제약이 2014년 국내에 출시한 보툴리눔 톡신 제제다. 지난 2월 국산 보툴리눔 톡신 제품 가운데 최초로 미국 식품의약국(FDA)의 허가를 획득했다.
이번 CHMP의 허가승인 권고로 나보타는 유럽시장 진출을 앞두게 됐다.
CHMP는 의약품에 대한 유효성, 안전성 등 과학적 평가 결과를 바탕으로 허가 여부를 논의해 유럽연합 집행위원회(EC)에 그 의견을 제시하는 기구다. 집행위원회는 CHMP의 권고일로부터 3개월 이내에 판매허가 여부에 대해 최종 결정을 내려야 한다.
집행위원회가 최종 허가 결정을 내리면 나보타는 유럽연합 내 28개 국가와 노르웨이, 아이슬란드, 리히텐슈타인이 속한 유럽경제지역(EEA) 3개국 등 유럽 내 31개국에서 판매될 수 있다.
현재 나보타의 유럽 판권은 북미 및 유럽지역 파트너사 에볼루스(Evolus)가 보유하고 있다.
전승호 대웅제약 사장은 “미국에 이어 유럽에서의 최종 판매허가도 긍정적으로 기대한다”며 “미국과 유럽은 전세계 보툴리눔 톡신 시장의 70% 이상을 차지하고 있어 나보타의 유럽 진출은 글로벌 브랜드로서 위상을 높일 것”이라고 말했다.
allzero@newspim.com