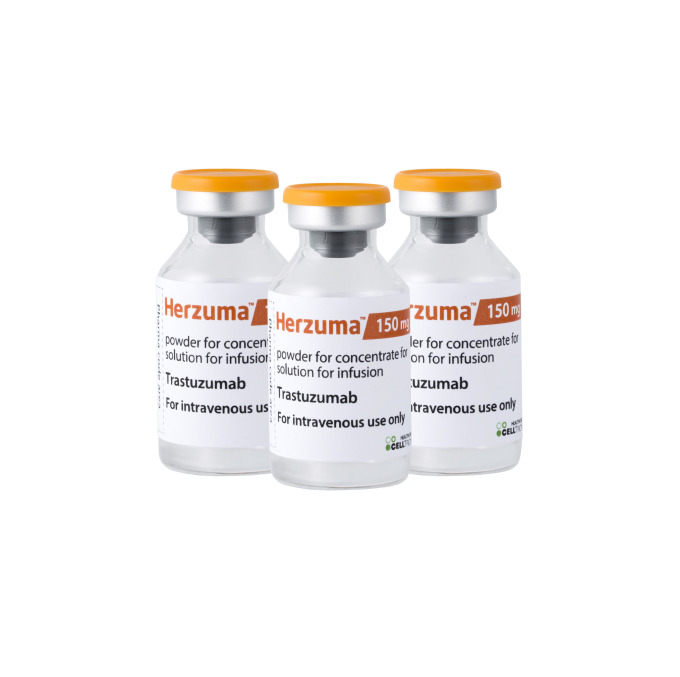
[서울=뉴스핌] 김근희 기자 = 셀트리온은 최근 미국 식품의약국(FDA)에 유방암 치료용 항체 바이오시밀러(바이오의약품 복제약) '허쥬마'의 판매 승인을 위한 추가 보완자료를 공식 제출했다고 18일 발표했다. 이에 따라 허쥬마 미국 허가 심사가 재개될 전망이다.
셀트리온은 지난해 5월 허쥬마의 바이오의약품 품목허가를 신청했으나, 올해 4월께 FDA로부터 허쥬마의 허가 관련 자료 보완을 요구하는 '최종 보완요구 공문(CRL)'을 받은 바 있다.
회사는 연내에 허쥬마의 허가 심사를 마치기 위해 총력을 기울일 계획이다. 통상적으로 FDA 바이오의약품 품목허가는 추가 보완서류 접수 후 6개월 이내에 마무리된다.
셀트리온은 허쥬마의 미국 허가를 획득하게 되면, 미국 내 독점 판매 계약을 체결한 글로벌 제약사 테바를 통해 허쥬마를 미국 시장에 조속히 선보일 방침이다.
회사 관계자는 "셀트리온은 유럽에서 누적된 램시마의 처방 데이터를 바탕으로 글로벌 바이오제약시장에서 신뢰를 받고 있다"며 "허쥬마 판매 허가 및 출시 시점을 앞당기기 위해 최선을 다하겠다"고 말했다.
keun@newspim.com