[서울=뉴스핌] 김신영 기자 = 정형외과 임플란트 연구·제조 전문기업 시지메드텍(CG MedTech)은 자사의 척추 고정 장치 '이노버스 스파이널 시스템(이노버스)'이 미국 식품의약국(FDA) 승인을 획득한 데 이어, 최근 미국 병원에서 첫 수술에 성공적으로 적용되며 북미 시장 진출의 본격 신호탄을 쐈다고 23일 밝혔다.
이노버스는 작년 2월, 미국 식품의약국(FDA)으로부터 정식 판매 승인인 '510(k)'를 획득했다. 510(k)는 미국 내에서 의료기기를 판매하기 위해 반드시 통과해야 하는 허가 절차로, 기존에 이미 시판 중인 제품과 안전성과 효과 측면에서 본질적으로 동등하다는 점을 입증해야 한다. 글로벌 의료기기 시장 중에서도 특히 진입 장벽이 높은 미국 내 판매가 가능해졌다는 점에서 의미가 크다.
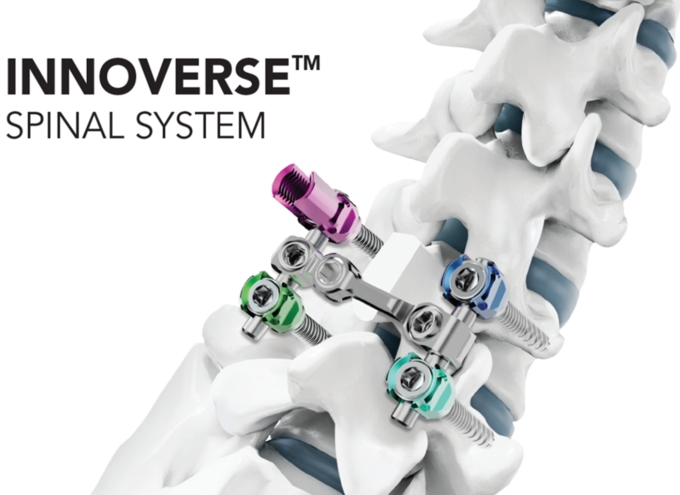
이번 승인에서 주목할 점은, 이노버스가 국내 제조사로는 최초로 대표적인 척추 수술 내비게이션 시스템인 미국 메드트로닉(Medtronic)사의 스텔스스테이션(StealthStation)과의 연동이 입증돼 해당 시스템과 호환 가능한 척추 고정 시스템으로 FDA로부터 정식 승인 받았다는 점이다.
이후 올해 3월 미국 시장에 공식 론칭했고, 최근 미국 텍사스주 '메모리얼 허만 병원(Memorial Hermann Surgical Hospital)'에서 이노버스를 활용한 첫 수술이 성공적으로 시행됐다. 수술은 정형외과 및 성형외과 전문의 자격을 모두 갖춘 스티븐 J. 시어 박사(Dr. Steven J. Cyr)가 집도했으며, 허리 아래쪽(L3~S1) 세 부위를 고정하는 척추 수술로 진행됐다.
유현승 시지메드텍 대표는 "이노버스는 단순한 신제품이 아니라, 시지메드텍의 기술력과 임상 경험을 집약한 통합형 척추 수술 솔루션"이라며 "이노버스를 북미 주요 병원에 순차 공급하는 한편 글로벌 시장 확대에도 속도를 낼 계획"이라고 밝혔다.
sykim@newspim.com