VEGFR TKI/PD-1 계열 항암제…새로운 치료옵션 제시
[서울=뉴스핌] 배요한 기자 = 에이치엘비(HLB)는 항암신약 리보세라닙(rivoceranib)과 면역항암제 캄렐리주맙(camrelizumab)을 병용한 간암 1차 치료제 임상 3상 연구 결과가 렌바티닙+펨브롤리주맙, 티슬리주맙 임상 결과와 함께 유럽종양학회(ESMO 2022) 소화관 종양분야 '콩그레스 하이라이트(Congress Highlights)' 논문으로 선정됐다고 14일 밝혔다.
발표자인 네덜란드 암스테르담 UMC 암 전문의인 Hanneke van Laarhoven 교수는 이중 리보세라닙 병용요법이 유일하게 긍정적인(positive) 임상 결과를 도출해 유효성을 입증했다고 전했다.
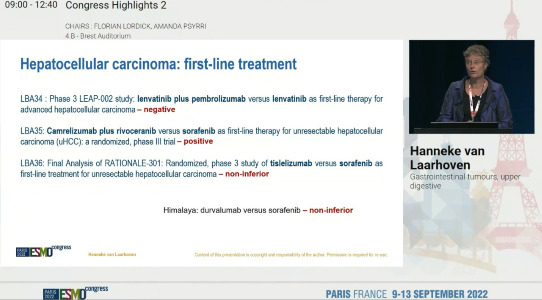
콩그레스 하이라이트는 ESMO 학회 마지막 날 각 분야에서 높은 연구성과를 보였거나 새로운 치료옵션을 제시한 연구 결과를 선정해 발표하는 절차로 각계 전문가로 구성된 운영진에서 선정한다.
실제 리보세라닙 병용 임상 결과는 학회 기간 중 각계 전문가들과 업계 관계자들에게 큰 주목을 받았다. 면역항암제가 비절제성 간암 분야에서 계속 고전하는 가운데 두 약물은 항신생혈관생성 TKI(티로신키나아제 억제제) 약물과 면역관문억제제(PD-1)의 조합으로는 최초로 유효성을 입증해 간암 치료에 새로운 옵션을 제시했기 때문이다.
특히 543명의 다국가 환자를 대상으로 진행한 임상 결과 전체생존기간(mOS)이 22.1개월을 보여 역대 간암 임상 중 최장의 생존기간을 보였으며, 사망위험이나 중증 진행위험도 40~50% 가까이 줄여주는 것으로 확인됐다. 이 밖에도 완전 관해 3명을 포함 무진행생존기간 중앙값(mPFS) 5.6개월 vs. 3.7개월, 객관적반응률(ORR) 25.4% vs. 5.9% 등이 도출돼 모든 지표에서 통계적 유의성이 확인됐다.
임상 환자에 아시아인과 비아시아인이 모두 포함돼 지역별 인종과 발병원인에 상관없이 일관된 치료 효능과 안전성을 확인했다는 점도 이번 임상의 주요 성과로 꼽힌다.
간암 분야 최고 권위자 중 한명으로 유럽암학회(ESMO) 운영위원이자 홍콩중문대학교 의과대학 암 전문의인 스티븐 찬(Stephen Chan) 교수도 "리보세라닙과 캄렐리주맙 병용요법이 지역에 상관없이 간암 1차 치료제 분야에서 높은 효능과 안전성을 입증해 실제 의료 현장에서 빨리 처방할 수 있기를 바란다"며 "기존 진행성 위암 치료법을 변화시킬 수 있는 잠재력이 높다"고 평가했다.

HLB는 선양낭성암 1차 치료제, 간암 1차 치료제 임상에서 높은 유효성을 확인함에 따라 품목허가 절차에도 속도를 낼 방침이다.
선낭암의 경우 올해 미국 FDA에 신약허가신청(NDA)을 진행하며, 간암의 경우도 내년 초에는 NDA를 진행한다는 계획이다. 리보세라닙은 선낭암, 간암에 대해, 캄렐리주맙은 간암에 대해 이미 미국에서 희귀의약품으로 지정돼 있어 빠른 심사와 인허가 혜택을 받을 수 있을 것으로 전망된다.
FDA에 NDA나 BLA(바이오의의약품허가신청서) 접수가 완료되면 통상 10개월 가량 심사기간을 거치지만, 우선심사 대상이 될 경우 해당 기간이 6개월 이내로 단축될 수 있다.
HLB 관계자는 "리보세라닙에 대한 임상 결과가 세계 양대 암학회인 ASCO(미국암학회)와 ESMO에서 연이어 발표된데 이어 ESMO의 하이라이트 논문에도 선정됨에 따라 올해 업계는 물론 학계에서도 가장 주목받는 항암신약물질이 됐다"며 "리보세라닙 자체 효능은 물론 면역항암제 등 다른 항암제와의 높은 범용성도 입증된 만큼 앞으로 다국적 제약사들과 폭넓은 협업이 이뤄질 것으로 기대된다"고 말했다.
yohan@newspim.com
























