업계 "펙사백 기대감만 충만했 회사..거품 걷히는 과정"
[서울=뉴스핌] 박다영 기자 = 신라젠의 항암 바이러스 물질 '펙사벡'이 글로벌 임상 3상 중단 권고를 받으면서 신라젠의 남은 파이프라인에 관심이 쏠린다.
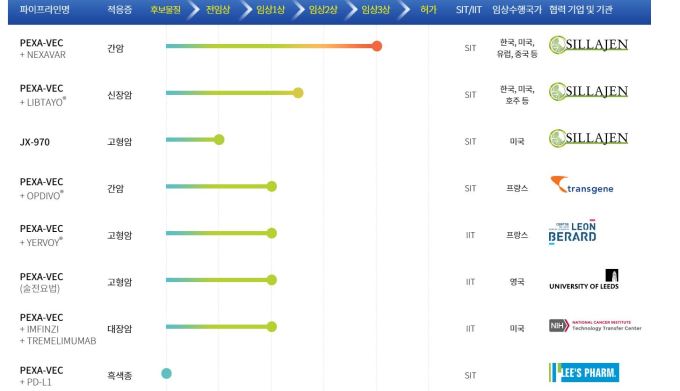
펙사벡은 신라젠의 핵심 파이프라인이다. 현재 신라젠이 가동중인 8개 임상 중 7개가 펙사벡을 기반으로 설계됐을 정도다.
신라젠은 2015년 10월부터 진행성 간암환자 600명을 대상으로 펙사벡의 글로벌 임상 3상을 진행해왔다. 펙사벡을 종양 내 투여한 후 넥사바를 투여한 환자군 300명과 넥사바를 단독으로 투여한 환자군 300명의 전체 생존율을 비교하는 방식으로 진행했다.
하지만, 이 임상은 1일(현지시간) 미국 데이터모니터링위원회(DMC)와 펙사벡 무용성 평가 관련 미팅에서 중단을 권고받았다.
무용성 평가는 신약이 치료제로서 가치가 있는지를 따져보는 중간 평가다. 임상을 지속할지 여부를 판단하는 잣대다. 무용성 평가에서 문제가 없었으면 신라젠은 2020년 12월 임상 3상을 완료할 계획이었다. 하지만, 이번 임상 3상 중단 권고로 펙사벡 임상은 제동이 걸렸다.
◆ 신라젠, 가동 중인 8개 파이프라인 중 7개가 펙사백 기반
이번 결과로 신라젠은 상업화를 눈앞에 둔 임상시험을 중단하게 될 것으로 보인다. 다만, 현재 신라젠이 가동중인 8개 파이프라인 중 7개가 펙사벡을 기반으로 파생됐다.
이번에 중단을 권고받은 임상 3상 외에 펙사벡과 관련된 임상은 대부분 기존 면역항암제와 펙사벡을 함께 투여하는 병용요법이다.
신라젠은 리제네론의 면역항암제 '리브타요'와 전이성 신장암에 대해 한국, 미국, 유럽, 중국 등에서 병용 임상 1b상을 진행중이다. 중단 권고를 받은 임상 3상 외에 가장 앞선 파이프라인이다.
미국에서는 대장암을 적응증으로 아스트라제네카의 면역항암제 '임핀지'와 트레멜리무맙의 3중요법으로 임상 1상을 하고 있다.
프랑스에서는 BMS의 '옵디보'와 함께 간암에 대해 임상 1/2a상을 진행하고 있다. 고형암에 대해 '여보이'와 함께 투여하는 1상도 진행중이다.
펙사벡 외에는 신규 항암바이러스물질 'JX-970'이 현재 미국에서 고형암을 적응증으로 전임상 단계에 있다.
◆ 병용 치료 시너지 강조한 신라젠, 업계 "펙사백 기대감은 거품"
펙사벡은 신라젠이 개발해온 간암 치료제다. 바이러스 유전자를 재조합해 암세포만 선택적으로 공격한다. 종양세포에 침투한 후 증식해서 이 세포를 터뜨리고 주변 면역세포의 활성도는 높이는 작용 기전이다.
신라젠은 펙사벡과 면역항암제의 암 치료 시너지를 강조해왔다. 면역항암제가 평소 암세포를 인식하지 못하는 면역세포의 공격력을 키워 결과적으로 두 약물을 함께 투여하면 암 치료 효과를 극대화할 수 있다는 이유에서다.
신라젠은 이 달 임핀지와 펙사벡을 병용했을 때 MSI-L(저빈도 현미부수체 불안정성) 대장암 환자에서 면역력이 상승했다고 밝힌 바 있다. 병용투여의 시너지가 크다는 주장에 따르면, 이번 임상 3상 중단 위기로 진행중인 7개 병용 임상의 결과를 전부 예측하기는 어렵다.
하지만 업계에서는 그동안 펙사벡에 쏠린 관심이 거품이었다는 지적이 나온다.
업계 한 관계자는 "펙사벡에 대한 기대감 만으로 비용만 있고 매출이 없는 회사였는데 그 거품이 걷히는 것"이라고 말했다.
allzero@newspim.com























