"미국서 연내 피험자 투여 완료 목표"
[편집자] 이 기사는 03월 08일 오전 09시39분 프리미엄 뉴스서비스'ANDA'에 먼저 출고됐습니다. 몽골어로 의형제를 뜻하는 'ANDA'는 국내 기업의 글로벌 성장과 도약, 독자 여러분의 성공적인 자산관리 동반자가 되겠다는 뉴스핌의 약속입니다.
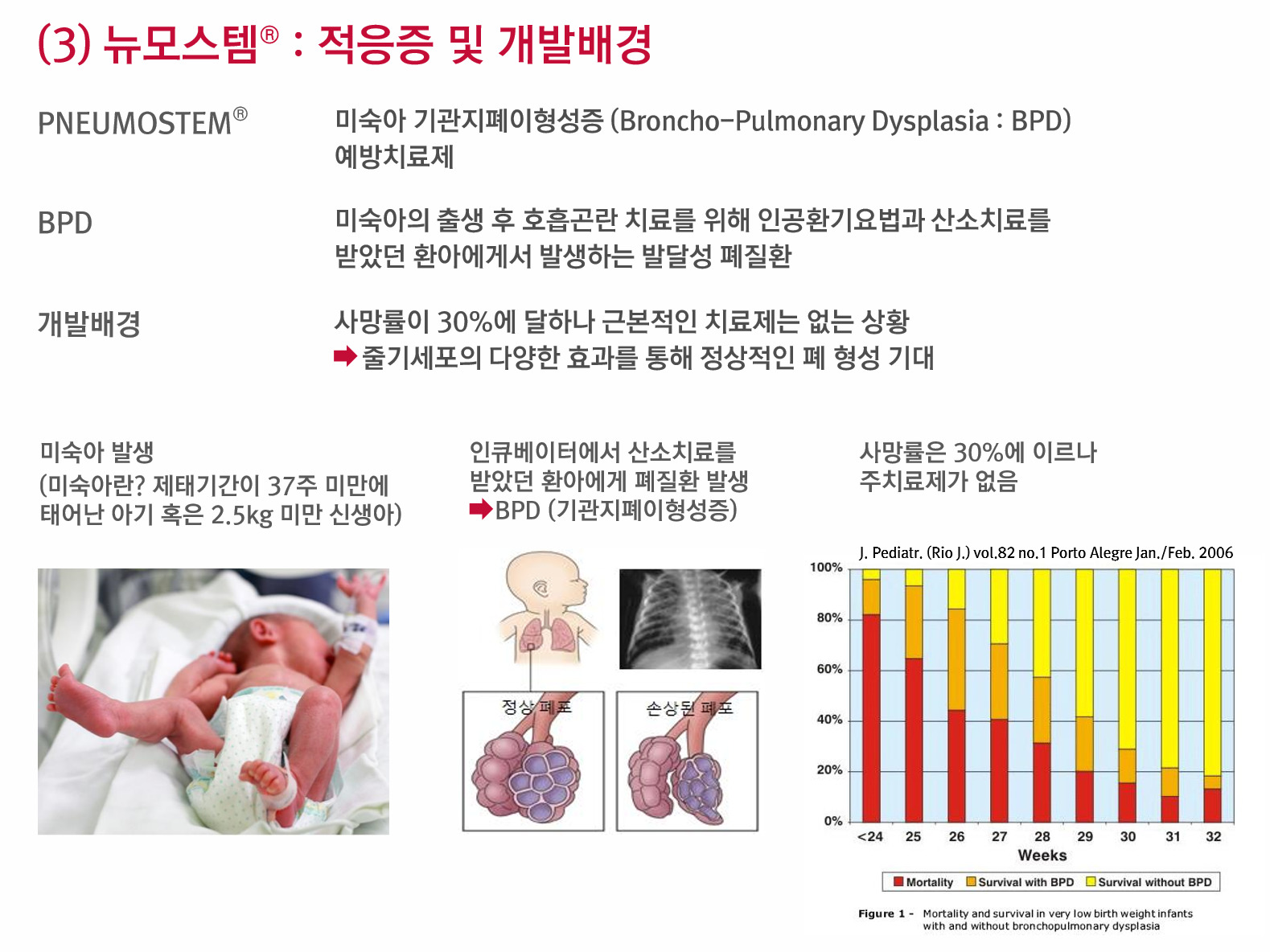
[뉴스핌=김양섭 기자] 줄기세포 전문업체 메디포스트가 뉴모스템(PNEUMOSTEM, 미숙아 기관지 폐이형성증/급성호흡곤란 치료제)에 대해 상반기내 국내서 희귀의약품 지정을 신청할 예정이다.
8일 메디포스트 관계자는 "국내서 뉴모스템에 대해 현재 임상 2상 투여를 마치고 결과 분석을 마무리하는 중"이라며 "상반기내에 임상 결과 보고서를 식약처에 제출하고, 희귀의약품 지정을 신청할 것"이라고 밝혔다. 이어 "희귀의약품 지정을 받아 내년에 조건부 허가를 받는 것을 목표로 하고 있다"고 덧붙였다.
뉴모스템은 제대혈(탯줄혈액)에서 추출한 간엽줄기세포를 원료로 한 기관지폐이형성증 예방 치료제다. 치료제 개발이 성공적으로 완료되면 미숙아의 폐 조직을 재생시키고 염증소견을 개선시키는 효과가 있을 것으로 기대를 모으고 있다.
희귀의약품이란 대체 의약품이 없어 긴급하게 도입할 필요가 있는 의약품을 말한다. 희귀의약품으로 지정받으면 임상시험의 일부를 면제받을 수 있는 등 허가 요건이 간소화된다.
뉴모스템은 지난 해 보건복지부 산하 한국보건의료연구원으로부터 '신개발 유망의료기술'에 선정되기도 했다. '신개발 유망의료기술'은 5년 내 국내 도입 가능성이 있는 의료기술에 대해 잠재적 영향력을 분석, 정부와 산업계 및 국민 등 수요자에게 선제적으로 정보를 제공하기 위해 지난해부터 한국보건의료연구원이 선정하고 있다.
노경철 SK증권 연구원은 뉴모스템에 대해 "국내서 희귀의약품으로 지정받으면 임상 3상을 진행하면서 조건부 허가를 받을 수 있다"며 "최근 정부에서도 첨단 재생의료 제품의 신속한 시장 진입을 추진하고 있기 때문에 내년부터 판매할 수 있을 것"이라고 전망했다.
미국과 유럽 등에서는 이미 희귀의약품 지정을 받았다. 메디포스트는 지난 2013년 뉴모스템에 대해 미국에서 희귀의약품 지정을 받은 이후 임상 1·2상에 착수했다. 미국 시장 계획에 대해 메디포스트 관계자는 "현재 임상 1·2상을 진행 중인데, 올해 안에 피험자 투여를 완료하는 것을 목표로 하고 있다"고 말했다.
유럽의약품청(EMA)에서도 희귀의약품으로 지정된 상태다. 이에 따라 메디포스트는 유럽연합(EU) 28개 회원국에서 시판 허가 후 12년간 독점 판매할 권리를 확보했다. 미국과 유럽에서 매년 4~5만명 정도의 신생아가 잠재적 환자군에 속해 있다.
한편, 작년 별도재무제표 기준으로 메디포스트는 매출 351억원, 영업이익 12억원, 당기순이익 35억원을 기록했다. 연결재무제표 기준 실적은 매출 376억원, 영업손실 2억원, 당기순이익 29억원이다. 주가는 지난해 7월 16만대 고점에서 하락해 최근 수개월간 7만원대~11만원대의 박스권 장세를 보이고 있다. 지난 7일 종가는 8만5900원이다.
 |
| <자료=메디포스트> |
[뉴스핌 Newspim] 김양섭 기자 (ssup825@newspim.com)