[서울=뉴스핌] 이영기 기자 = 삼일제약은 바이오스플라이스 테라퓨틱스(Biosplice Therapeutics)는 무릎 골관절염 치료신약 후보물질 '로어시비빈트(Lorecivivint)'에 대한 임상 3상의 장기 연장시험인 'OA-07' 결과를 2023년 11월13일 캘리포니아 샌디에고에서 개최된 미국 류마티스학회(ACR)에서 구두 발표했다고 4일 밝혔다.
'로어시비빈트'는 미국 샌디에고 소재 바이오텍인 '바이오스플라이스 테라퓨틱스(Biosplice Therapeutics)'가 개발중인 무릎 골관절염 치료신약 후보물질이다. 지난 2021년 3월 삼일제약이 국내 허가 및 판매에 대한 독점권리를 확보한 바 있다.
'로어시비빈트'는 'CLK/DYRK 키나제(인산화효소)' 억제제로 'Wnt 신호'를 조절하는 기전을 갖고 있어 세계 최초의 골관절염 근본적 치료제(DMOAD ; Disease-Modifying Osteoarthritis Drug)를 목표로 개발되고 있다.
'OA-07'은 미국에서 12개월 동안 임상 3상인 'OA-11'을 완료한 환자중 276명을 대상으로 진행한 장기 연장시험으로 '로어시비빈트'를 매년 1회씩 3년간 투여했을 때 '구조 개선 가능성(structure improvement potential)'을 평가하고자 설계됐다.
'OA-07' 시험 1년차(OA-11 시험 포함 시 2년차) 시험군에는 '로어시비빈트' 0.07mg을 투여했으며, 대조군은 위약을 투여했다. 또한 'OA-07 시험' 2년차(OA-11 시험 포함 시 3년차)에는 시험군 및 대조군 모두 '로어시비빈트' 투여로 전환 해 전체 환자 모두에게 오픈라벨로 '로어시비빈트' 0.07mg를 투여했다. 'OA-07' 시험이 진행되는 동안 이전 시험인 'OA-11' 투약 결과에 대해서는 이중맹검을 유지했다.
임상 결과 3년간 매년 1회씩 총 3회 '로어시비빈트' 0.07mg을 투약 받은 시험군의 'mJSW(36개월)'은 -0.06mm, 위약 대조군의 'mJSW(24개월)'은 -0.21mm를 보였다. 두 환자군에서 0.15mm의 유의미한 'mJSW' 차이를 보였으며(p=0.045), 대조군에게 위약을 지속투여(36개월) 했다고 가정한 경우에는 시험군과 위약 대조군의 'mJSW' 차이는 0.26mm로 임상적 및 통계적으로 유의한 결과를 확인했다(p=0.001).
임상 시험에 사용된 'mJSW'는 무릎 관절 내측 공간 폭을 의미하며, 해당 너비에 따라 무릎 골관절염 진행 정도를 판단한다. X-레이로 촬영해 측정하며, 'mJSW'가 작을수록 골관절염 진행이 심한 것으로 판단하며, 'mJSW'가 증가할수록 골관절염이 개선된 것으로 판단한다.
특히 이번 임상에서 '로어시비빈트'는 무릎 골관절염이 상대적으로 덜 심각한 'KL 2단계(KL grade 2)' 환자에서 이점이 더 큰 것으로 확인됐다. 기준선 대비 시험군(36개월)의 'mJSW'는 0.17mm의 증가를 보였으며, '로어시비빈트' 투여군으로 전환하기 전 위약 대조군의 마지막 측정 시점(24개월) 대비 통계적으로 유의한 증가가 있었다(p=0.012). 위약 대조군을 '로어시비빈트' 투여군으로 전환하지 않고 계속해서 위약을 36개월간 지속 투여했다고 가정한 경우에는 시험군 과 위약 대조군의 'mJSW' 0.35mm 차이를 보여 임상적 및 통계적으로 유의한 결과를 확인했다(p=0.003).
이번 3상 임상 결과를 발표한 '바이오스플라이스'의 '유수프 야즈즈(Yusuf Yazici)' 박사는 "이번 임상결과는 '로어시비빈트'의 반복주사가 구조적 변화와 증상적 이점을 모두 제공할 수 있다는 가능성을 의미한다"고 설명했다..
삼일제약 관계자는 "이번 임상결과로 장기 안전성과 유효성이 확인됐다는데 큰 의미가 있고 무릎 골관절염 치료의 First-in-class 약물로 승인이 기대되는 만큼 국내 독점권리를 보유하고 있는 삼일제약에 의미 있는 신약 포트폴리오가 될 것으로 기대한다"고 말했다.
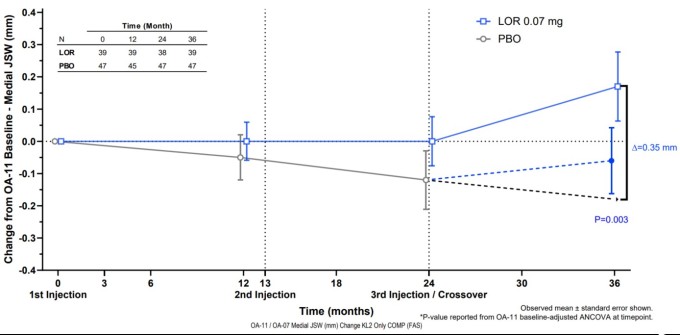 |
| 전체 피험자 대상 36개월 투여 비교임상 결과 [사진=삼일제약] |
007@newspim.com
 영상
영상