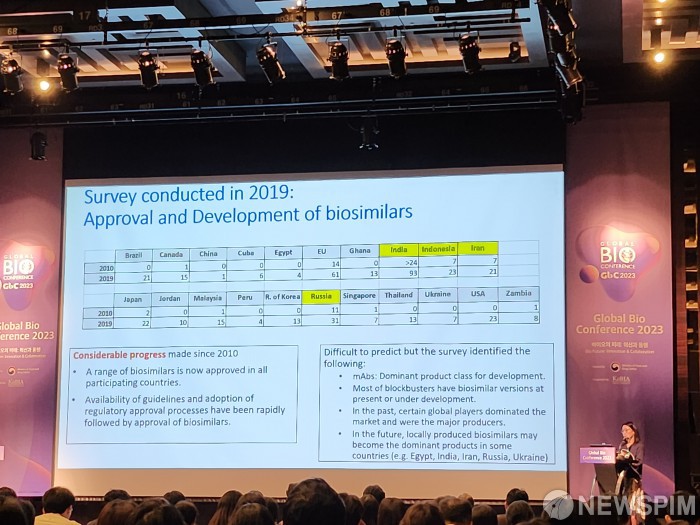
이집트, 인도, 이란 등에서 바이오시밀러 개발 수 늘어
대기업 중심에서 글로벌 전체로 지형 변화중
자원 부족해도 유효성, 안전성 검증하도록 가이드라인 변경
[서울=뉴스핌] 방보경 기자 = "머지않아 각국에서 자생적으로 바이오시밀러(local producing biosimilar)를 만들어낼 것입니다."
31일 글로벌 바이오 컨퍼런스(GBC)에서 WHO 소속 강혜나 박사는 미국이나 유럽 외 다른 국가에서도 바이오시밀러가 활발하게 개발될 거라고 설명했다. 유럽에서 2006년 첫 번째 바이오시밀러가 출시된 후, 서방 국가가 연구개발을 주도하고 여력이 되지 않는 국가들은 주로 바이오시밀러를 수입해 왔다. 강 박사는 몇 년 안에 그 지형이 바뀔 것이라고 예측했다.
 |
| [서울=뉴스핌] 방보경 기자 = 31일 글로벌 바이오 컨퍼런스(GBC)에서 WHO 소속 강혜나 박사가 '개정된 WHO 가이드라인: 바이오시밀러 평가'라는 주제로 발표하고 있다. 2023.08.31 hello@newspim.com |
특히 이집트, 인도, 이란, 우크라이나 등 국가에서 바이오시밀러 승인 수가 3배가량 뛰었다. 강 박사는 "모든 바이오시밀러가 WHO에서 요구하는 규정에서 만들어졌나를 컨펌하지는 않았다"면서도 "그렇다 하더라도 (그간) 진전이 있었다고 본다"고 말했다.
실제로 바이오시밀러 연구개발은 보편화되고 있다. 2010년 세계 각국에서는 '바이오시밀러'를 일컫는 말에 다른 용어를 썼다. 화학약품에서 쓰이는 '제네릭'이라는 단어도 바이오 의약품에 적용되기도 했지만 최근에는 '바이오시밀러'라는 용어 자체가 통일됐다. 강 박사는 "다양한 용어를 사용하면 혼동을 불러일으킬 수 있기에 최근의 트렌드를 긍정적으로 봤다"고 설명했다.
다만 각국이 바이오시밀러 개발에 참여하면서 규정을 바꿔야 할 필요성도 높아졌다. 글로벌 국가들의 상황이 다름을 고려해 WHO는 지난해 세부 가이드라인을 개정한 바 있다.
강 박사는 가이드라인을 수정하는 과정에서 중요하게 여긴 요소로 몇 가지를 꼽았다. 바이오시밀러 임상에 막 진입한 국가의 경우 오리지널 의약품(RBP)의 가격에 부담을 느끼거나 자국에서 자체적으로 의약품을 구하기 어렵다. 자원이 부족한 국가에서 규제기관(NRA)은 바이오시밀러 규제를 위해 선진국 규정과 정보에 의존하기도 한다. WHO는 이러한 상황에서도 유효성과 안전성을 검증할 수 있도록 가이드라인을 변경했다.
질이 낮아 바이오시밀러라고 말하기 어려운 의약품(non-innovator)이 유통되는 경우도 있어 관련 규정 개정을 이뤄냈다. 강 박사는 "이런 약들이 바이오시밀러로 유통되면서 태국에서 안전 문제가 있었다"며 "문제가 생기면 바이오시밀러 사용을 주저하게 되는 만큼, 이를 명확히 구분하려는 노력이 WHO와 각국 규제 기관에서도 이뤄져야 한다"고 덧붙였다.
그 외 상호교환성(interchangeability)의 의미에 대한 합의도 부족했다는 설명이다. 상호교환성이란 상호교환가능하다고 인정한 바이오시밀러를 약사가 임의로 오리지널 의약품을 대체해 처방할 수 있게 한 제도로, 현장에서는 처방이 이뤄지고 있음에도 각국에서 규제가 만들어지지 않은 상황이다.
한편 이날 GBC에서는 바이오시밀러의 미래 전망 등을 논한 '유전자재조합의약품 포럼' 외에도 백신 개발 및 보급에 대해 토의한 '백신 포럼' 등 주제별 포럼이 열렸다. 특히 AI 등 혁신 미래 기술의 현황과 전망을 공유하고 미래 대응 전략을 논의하는 '바이오디지털 융합 혁신기술 포럼'과 혁신의료기기 수출 지원을 위해 주요국 규제 동향과 연구개발 동향을 공유하는 '혁신의료기기 포럼'은 올해 처음 개최됐다.
hello@newspim.com
 영상
영상