[세종 = 뉴스핌] 김범주 기자 = 중앙대학교는 본교 약학대학 연구팀이 유전자 가위로 사용되는 Cas3 단백질의 구조를 세계 최초로 밝힌 데 이어 이를 기반으로 유전자 가위 단백질의 활성 조절 기전을 분자 레벨에서 규명하는 데 성공했다고 3일 밝혔다.
유전자 가위 시스템은 미래 혁신 치료법으로 주목을 받고 있다. 이번 연구 성과는 편집 능력 향상에 크게 기여할 것으로 예상된다.
박테리아와 바이러스는 오랫동안 생존 경쟁을 벌여 왔다. 박테리아는 자신을 공격한 바이러스의 유전 정보를 기억해 유사한 유전자를 지닌 바이러스가 침투하면 즉각 제거하는 방식으로 스스로를 보호한다. 이런 박테리아의 방어·면역 시스템을 유전자 가위 또는 크리스퍼-카스라 부른다.
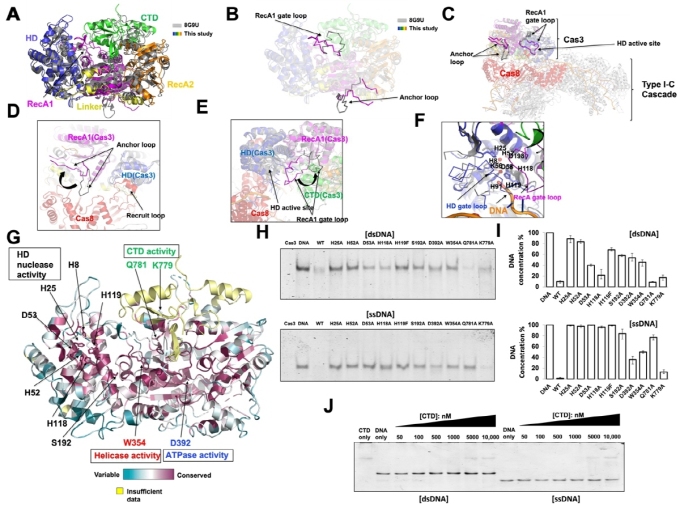
이때 침투한 바이러스의 유전정보인 DNA를 자르는 단백질이 Cas3다. Cas3 단백질은 크리스퍼-카스 시스템에서 특정 서열의 DNA를 직접 자르는 역할을 하기에 미래 혁신 치료법으로 연구되고 있는 유전자 가위의 핵심 역할 단백질로 꼽힌다.
박현호 교수 연구팀은 Cas3의 3차 구조 분석을 수행해 Cas3가 활성화됐을 때와 비활성화 상태일 때의 구조를 비교했다. 그 결과 어떠한 구조적 변화를 통해 활성 여부가 조절되는지를 세계 최초로 밝히는 데 성공했다.
한편 중앙대 측은 이번 연구가 중견연구자지원사업과 BK21+ 사업의 지원을 받았다고 밝혔다. 상세한 연구 내용은 '3차 구조기반의 타입 I-C Cas3 활성 기전(Structural basis of Cas3 activation in Type I-C CRISPR-Cas system)' 논문을 통해 확인할 수 있다.
박 교수는 "이번 연구성과는 치료 목적의 유전자 가위 시스템을 정교하게 조절하고 응용하는 데 많은 도움이 될 것"이라고 말했다.
 |
| /제공=중앙대학교 |
wideopen@newspim.com
 영상
영상