"활성산소가 일으키는 모든 질병에 치료효과 기대"
[서울=뉴스핌] 김영섭 기자 = 국내 연구진이 파킨슨병 주요 원인인 활성산소를 선택적으로 제거하는 기술을 세계 최초로 개발했다.
기초과학연구원(IBS) 나노입자연구단 현택환 연구단장(서울대 화학생물공학부 교수)팀은 세포의 안팎으로 존재하는 활성산소를 영역별로 제거하는 세리아(산화세륨·CeO2) 나노입자 시스템을 개발, 파킨슨 질병 모델 생쥐에 적용해 치료 효과를 확인하는 데 성공했다고 29일 밝혔다.
이에 따라 이번에 개발된 세리아 나노입자 시스템은 활성산소로 생기는 질병들의 치료법 개발에 광범위하게 활용할 것으로 기대된다.
활성산소는 세포의 생존에 필수적인 요소로, 면역과 신호 전달에 중요하다.
하지만 농도가 지나치게 높아진 활성산소는 우리 몸에 필요한 생체 분자들을 무차별적으로 공격, 우리 몸에 필요한 생체 분자들의 전자를 빼앗아 산화시킨다. 이런 산화 스트레스는 세포를 늙게 하고 죽음에 이르게 한다.
특히 활성산소로 인한 산화 스트레스는 신경 퇴행성 질환인 파킨슨병의 주요 원인 중 하나로 알려져 있다. 세포의 미토콘드리아 또는 세포질 영역에 존재하는 활성산소로 인한 산화 스트레스가 있다. 신경 염증으로 인해 세포 바깥 영역에 생기는 활성산소도 파킨슨 발병에 관여한다.
이렇듯 파킨슨병은 발생 과정이 매우 복잡하다.
하지만 활성산소가 발생하는 위치에 따른 영향을 규명하고 치료제를 개발하는 방법이 맞지만 선택적인 활성산소 제거 기술이 전무했다.
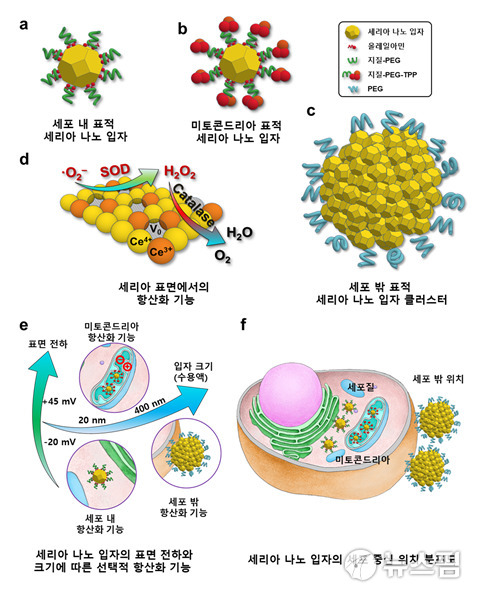
이에 IBS 나노입자연구단은 미토콘드리아, 세포질, 세포 밖 이렇게 3가지 영역에서의 활성산소를 구분, 이들을 각각 제거할 수 있는 세리아 나노입자 구조를 3가지 영역 맞춤형으로 만드는 데 성공했다.
연구진은 세리아 나노입자의 크기와 입자 표면의 전하 성질을 각각 다르게 함으로써 3가지 종류의 나노입자 체계를 완성했다.
크기가 작고(11나노미터, 1나노미터는 10억분의 1미터) 표면이 음전하를 띠는 세포질의 활성산소를 제거하는 세포질 표적 나노입자, 크기가 좀 더 크지만(22나노미터) 표면이 양전하를 띰으로써 미토콘드리아로 이동할 수 있는 미토콘드리아 표적 입자, 크기가 매우 커(400나노미터) 세포 내로 이동하지 못하고 세포 밖 활성산소를 제거하는 클러스터 형태의 나노입자가 그 구성이다.
세리아 나노입자 시스템의 활성산소 제거 효과를 확인하기 위해서는 파킨슨 병 모델 생쥐의 뇌(선조체)에 3가지 종류의 세리아 나노입자를 각각 주입해 치료 효과를 관찰했다.
관찰결과 3종의 세리아 나노입자 중 세포질 및 미토콘드리아 표적 세리아 나노입자들이 뇌염증과 산화 스트레스를 줄임으로써 도파민을 분비하는 신경 세포를 보호, 파킨슨병을 치료할 수 있음을 증명했다.
현택환 IBS 나노입자연구단장은 “이번 결과는 활성산소를 세포 내, 외 및 미토콘드리아에서 선택적으로 제거하는 기술을 최초로 개발 했을 뿐만 아니라 이들의 파킨슨 치료 효과와 발병 원인 규명, 나노입자의 새로운 의학적 적용을 보여준 사례”라고 말했다.
이번 연구결과는 독일 응용화학회지(Angewandte Chemie International Edition) 6월22일자 온라인판에 게재됐다.
◆ 연구자들이 직접 전하는 연구이야기

- 어려웠던 점은.
▲ 세포 밖에서 활성산소를 제거 하는 나노입자를 디자인하는 데 어려움이 있었다. 세포 밖에 존재 하려면 나노입자의 코어 크기가 200 나노미터(nm) 이상이 되어야 하는데 세리아 나노입자를 그 정도 크기로 만들면 표면적이 줄어들어서 활성산소를 제거 하는 기능이 재활용 되지 못 한다. 고심 끝에 3 nm 세리아 나노입자를 수십 만개를 클러스터 형태로 결합시키면 가능하겠다는 생각이 들었다. 그 결과 항산화 기능이 재활용 되는 세리아 클러스터를 개발했다.
- 이번 연구성과는 무엇이고 다른 연구와의 차별점은.
▲이번 연구결과는 활성산소를 세포의 위치에 따라 그 기능이 다를 것이라고 바라 본 과학적 시점 그 자체가 큰 성과이고 차별점이다. 지금까지 이런 관점에서 진행된 연구는 없었다. 이런 독창성과 성과를 인정받아 '독일 응용화학회지(Angewandte chemie)'에 투고한 지 최단 기간 2주 만에 곧 바로 상위 10% 이내 'Hot paper'로 게재 승인이 되는 진기록을 세웠다. 이번 연구진에 누적된 나노 기술을 바탕으로 개발된 세리아 나노입자 미토콘드리아 표적 나노입자, 세리아 나노입자 클러스터가 각각 세포 내, 외, 미토콘드리아 내의 활성산소를 선택적으로 제거가 가능함에 따라 파킨슨 질병의 발병에 세포 내 미토콘드리아 내 활성산소가 중요하다는 것을 밝혔다. 이 시스템은 활성산소가 발병에 관여하는 모든 질병들에 모두 유효할 것이라고 기대한다.
- 향후 연구계획은
▲ 활성산소를 선택적으로 제거 하는 세리아 나노입자 시스템은 세리아 나노입자를 선택적으로 세포의 특정 위치로 존재하게 하는 기술에 기초로 한다. 이 시스템을 이용해 세포 특정 위치로 항암제나 항산화제를 전달하는 연구와 특정 항산화 기능을 짧은 시간에 증폭시키는 기능을 추가해 세포에 적용하는 연구를 할 계획이다. 이 연구는 항암제와 치매 치료제 개발에 더욱 더 효과를 보일 것으로 예상한다.
kimys@newspim.com























